 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
于0.100mol/LFe3+和0.250mol/LHCl混合溶液中,通入H2S气体使之达到平衡,求此时溶液中Fe3+的浓度。已知H2S饱和
于0.100mol/LFe3+和0.250mol/LHCl混合溶液中,通入H2S气体使之达到平衡,求此时溶液中Fe3+的浓度。已知H2S饱和溶液的浓度为0.100mol/L;φ0(S/H2S)=0.141V;φ0(Fe3+/Fe2+)=0.71V。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“于0.100mol/LFe3+和0.250mol/LHCl混…”相关的问题
更多“于0.100mol/LFe3+和0.250mol/LHCl混…”相关的问题
 )和0.100mol·L-1NH4Cl的混合溶液。
)和0.100mol·L-1NH4Cl的混合溶液。
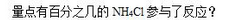
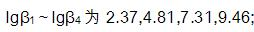 ,
,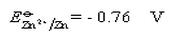
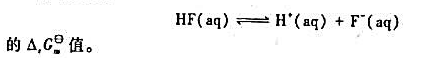
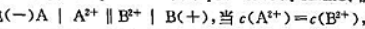 其电动势为0.360V,若c(A2+)=0.100mol·L-1,c(B2+)=1.00X10-4mol·L-1,此时电池电动势是多少?
其电动势为0.360V,若c(A2+)=0.100mol·L-1,c(B2+)=1.00X10-4mol·L-1,此时电池电动势是多少?
















