 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
反应C(s)+2H2(g)=CH4(g)在1000K时的ΔGm =19.29kJ当总气压=101kpa,气相组成为:H270%、N210%、
反应C(s)+2H2(g)=CH4(g)在1000K时的ΔGm=19.29kJ当总气压=101kpa,气相组成为:H270%、N210%、N210%的条件下,上述反应:
A正向进行
B平衡
C逆向进行
D不定
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
反应C(s)+2H2(g)=CH4(g)在1000K时的ΔGm=19.29kJ当总气压=101kpa,气相组成为:H270%、N210%、N210%的条件下,上述反应:
A正向进行
B平衡
C逆向进行
D不定
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“反应C(s)+2H2(g)=CH4(g)在1000K时的ΔG…”相关的问题
更多“反应C(s)+2H2(g)=CH4(g)在1000K时的ΔG…”相关的问题
1000K时,反应C(s)+2H2(g)====CH4(g)的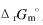 =19290J/mol。现有与碳反应的气体,其中含有CH4(g)10%,H2(g)80%,N2(g)10%(体积%)。试问:
=19290J/mol。现有与碳反应的气体,其中含有CH4(g)10%,H2(g)80%,N2(g)10%(体积%)。试问:
(1) T=1000K, p=101.325kPa时, 甲烷能否形成?(2) 在(1) 的条件下, 压力需增加到若干, 上述合成甲烷的反应才可能进行?
1000K时,反应C(s)+2H2(g)==CH4(g)的△rGmΘ=19 290J/mol。现有与碳反应的气体,其中含有CH4(g)10%,H2(g)80%,N2(g)10%(体积%)。试问: (1)T=1000K,P=100kPa时,甲烷能否形成? (2)在(1)的条件下,压力需增加到多少,上述合成甲烷的反应才可能进行?
写出下列反应的平衡常数表达式(Kp,Kc和Kx都可以)。 (1)CH4(g)+2O2(g)=CO2(g)+2H2O(1) (2)2H2S(g)=2H2(g)+2S(s) (3)PbI2(s)=Pb2+(aq)+2I-(aq) (4)AgCl(s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)
已知化学反应式CH4(g)+CO2(g)===2CO(g)+2H2(g):
(1)利用附录(在教材中)中各物质的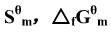 ,数据,求上述反应在25℃时的
,数据,求上述反应在25℃时的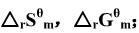
;(2)利用附录(在教材中)中各物质的△rGm数据,求上述反应在25℃时的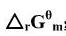 ;
;
(3)25℃时,若始态CH4(g)和CO2(g)的分压均为150kPa,末态CO(g)和H2(g)的分压均为50kPa,求反应的△rSm和△rGm。
A.CO2(g)+CaO(s)→CaCO3(S)
B.1/2H2(g)+1/2I2(g)→HI(g)
C.H2(g)+Cl2(g)→2HCl(g)
D.H2(g)+1/2O2(g)→H20(g)
已知下列反应在298.15K的平衡常数:
(1)SnO2(s)+2H2(g) 2H2O(g)+Sn(s)
2H2O(g)+Sn(s)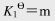
(2)H2O(g)+CO(g) H2(g)+CO2(g);
H2(g)+CO2(g);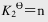
计算反应2CO(g)+SnO2(s) Sn(s)+2CO2(g)在298.15K时的平衡常数KΘ3。
Sn(s)+2CO2(g)在298.15K时的平衡常数KΘ3。
A.12ΔH3+5ΔH2-2ΔH1
B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1
D.ΔH1-5ΔH2-12ΔH3
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247kJ/mol
C—H键的键能约为413kJ/mol,O—H键的键能约为463kJ/mol,H—H键的键能约为436kJ/mol,则CO2中C=O键的键能约为()。
A.797.5kJ/mol
B.900.5kJ/mol
C.962.5kJ/mol
D.1595kJ/mol
能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a()kJ•mol-1、-bkJ•mol-1、-ckJ•mol-1;②H2O(l)=H2O(g);△H=+dkJ•mol-1
则△H1=()(用含字母a、b、c、d的代数式表示)kJ•mol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g)△H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
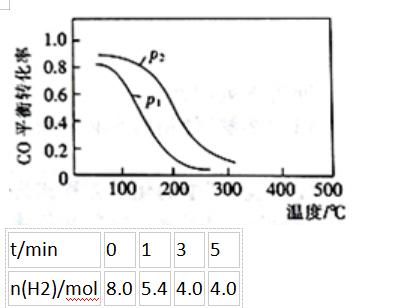 ①△H2()(填“>”“<”或“=”)0。
①△H2()(填“>”“<”或“=”)0。
②下列说法正确的是()(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③0〜3min内用CH3OH表示的反应速率v(CH3OH)=()mol•L-1·min-1。(计算结果保留两位有效数字)
④200℃时,该反应的平衡常数K=()。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡()(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6L甲烷,测得电路中转移1.2mol电子,则甲烷的利用率为()。
一个密闭容器中,在504℃二甲醚按(CH3) 2O(g)→CH4 (g)+H2 (g)+CO(g)式分解,测得二甲醚分压力随时间的变化如下:
 试求:(1)反应级数;(2)速率常数;(3)在1000 S时气体总压力。
试求:(1)反应级数;(2)速率常数;(3)在1000 S时气体总压力。