 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
从2L1mol£¯LNAOH溶液中取出100ml,下面有关这100ml溶液的叙述,错误的是()
A.浓度为0.1mol/l
B.浓度为1mol/l
C.含NAOH4g
D.含NAOH0.1mol
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.浓度为0.1mol/l
B.浓度为1mol/l
C.含NAOH4g
D.含NAOH0.1mol
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“从2L1mol£¯LNAOH溶液中取出100ml,下面有关这…”相关的问题
更多“从2L1mol£¯LNAOH溶液中取出100ml,下面有关这…”相关的问题
准确量取30.00ml弱酸,加水稀释至100ml。以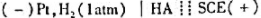 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
(1)弱酸HA的Ka。
(2)原弱酸HA的浓度。
准确量取30.00ml弱酸HA,加水稀释至100ml,在下列电池中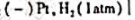
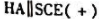 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
将1.000g钢样中的S转化成SO3,然后被50.00mLc(NaOH)=0.01000mol/LNaOH溶液吸收,过量的NaOH再用c(HCl)=0.01400mol/LHCI溶液滴定,用去22.65mL,计算钢样中的S含量是多少?
甲、乙两瓶酒精溶液分别重300克和120克;甲中含酒精120克,乙中含酒精90克。从两瓶中应各取出()才能兑成浓度为50%的酒精溶液140克。
A.甲100克,乙40克
B.甲90克,乙50克
C.甲110克,乙30克
D.甲70克,乙70克
A.200
B.240
C.250
D.260
A.甲l00克,乙40克
B.甲90克,乙50克
C.甲ll0克,乙30克
D.甲70克,乙70克
A.甲l00克,乙40克
B.甲90克,乙50克
C.甲ll0克,乙30克
D.甲70克,乙70克
称取干燥OH-型阴离子交换树脂1.000g,放入干燥的锥形瓶中,加入0.1242mol/L HCl溶液200.00mL,摇匀加塞,放置24h。吸取上层清液50.00mL,加入甲基橙指示剂数滴,用0.1010mol/LNaOH溶液滴定至呈橙红色为终点,用去NaOH溶液48.00mL。计算该树脂的交换容量是多少?
取酒石酸(H2C4H4O6)与甲酸(HCOOH)混合液10.00mL,用0.1000mol/LNaOH滴定至C4H4O62-与HCOO-,耗去15.00mL。另取10.00mL混合液,加入0.2000mol/L Ce(N)溶液30.00mL,在强酸性条件下,酒石酸和甲酸全部被氧化成CO2,剩余的Ce(Ⅳ)用0.1000mol/L Fe(Ⅱ)回滴,耗去10.00mL。计算混合液中酒石酸和甲酸的浓度。[提示:Ce(Ⅳ)的还原产物为Ce(Ⅲ)。]
取0.8206g邻苯二甲酸氢钾(KHC8H4O4),溶于水后用c(NaOH)=0.2000mol/LNaOH标准滴定溶液滴定,问需消耗NaOH溶液多少毫升?