 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在体积为1.0×10-2 dm-3,浓度为0.0015 mol.dm-3的MnSO4溶液中,加入体积为5.0× 10-3dm-3浓度为
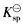 (Mn(OH)2)=2.1×10-13] (2)向体积为1.0×10-2dm3浓度为0.0015 mol.dm-3的MnSO4溶液中,加入质量为0.495 g 的(NH4)2SO4固体,再加入体积为5.0×10-3dm3,浓度为0.15 mol.dm-3的氨水,能否生成Mn (OH)2沉淀?设加入(NH4)2SO4固体后总体积不变。
(Mn(OH)2)=2.1×10-13] (2)向体积为1.0×10-2dm3浓度为0.0015 mol.dm-3的MnSO4溶液中,加入质量为0.495 g 的(NH4)2SO4固体,再加入体积为5.0×10-3dm3,浓度为0.15 mol.dm-3的氨水,能否生成Mn (OH)2沉淀?设加入(NH4)2SO4固体后总体积不变。
 答案
答案
×
本题主要考查溶度积规则的具体应用,主要利用溶度积常数来检验、判断某一沉淀溶解过程进行的方向和程度。如在反应MxAyxMy+(aq+)+yAx-(aq)中,对于MxAy而言:①若[My+]x[Ax-]y=(MxAy),溶液饱和,体系处于平衡状态;②若[My+]x[Ax-]y<(MxAy),溶液未饱和,不能生成MxAy,相反,固相的MxAy会不断溶解,直至固相全部溶解或溶液达到饱和;③若[My+]x[Ax-]y>(MxAy),溶液过饱和,将会有MxAy晶体析出,即会生成MxAy,直至达剑新的平衡。解(1)加入氨水后起始浓度/(mol.dm-3)0.0500平衡浓度/(mol.dm-3)0.05-xxx解得x=9.49×10-4[Mn2+][OH-]2=1×10-3×(9.49×10-4)2=9×10-10>所以能有Mn(OH)2沉淀生成。(2)加氨水后[Mn2+]=1×10-3mol.dm-3超始浓度/(mol.dm-3)0.050.50平衡浓度/(mol.dm-3)0.05-x0.5+xx解得x=1.8×10-5mol.dm-3[Mn2+][OH-]2=1×10-3×(1.8×10-5)2=3.24×10-13<所以没有Mn(OH)2沉淀生成。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案

 更多“在体积为1.0×10-2 dm-3,浓度为0.0015 mo…”相关的问题
更多“在体积为1.0×10-2 dm-3,浓度为0.0015 mo…”相关的问题
 均为0.10mol·dm-3溶液中,Ca2+浓度为2.0×10-2mol·dm-3,Ag+浓度为1.0×10-3mol·dm-3。用2.0×10-2mol·dm-3EDTA滴定其中的Ca2+,能否准确滴定?
均为0.10mol·dm-3溶液中,Ca2+浓度为2.0×10-2mol·dm-3,Ag+浓度为1.0×10-3mol·dm-3。用2.0×10-2mol·dm-3EDTA滴定其中的Ca2+,能否准确滴定?


















