 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算BaSO4在2.0mol/LHCl溶液中的溶解度。已知BaSO4的Ksp=1.1×10-10,H2SO4的=1.2×10-2。
计算BaSO4在2.0mol/LHCl溶液中的溶解度。已知BaSO4的Ksp=1.1×10-10,H2SO4的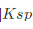 =1.2×10-2。
=1.2×10-2。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算BaSO4在2.0mol/LHCl溶液中的溶解度。已知BaSO4的Ksp=1.1×10-10,H2SO4的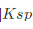 =1.2×10-2。
=1.2×10-2。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算BaSO4在2.0mol/LHCl溶液中的溶解度。已知B…”相关的问题
更多“计算BaSO4在2.0mol/LHCl溶液中的溶解度。已知B…”相关的问题
称取0.5000g煤试样,灼烧并使其中的硫完全氧化为SO42-。处理成溶液并除去重金属离子后,加入0.05000mol/L的BaCl2溶液20.00mL,使其生成BaSO4沉淀,过量的Ba2+用0.02500mol/L的EDTA标准溶液滴定,用去20.00mL。计算煤中硫的质量分数。
经计算判断反应Zn2+(0.10mol·L-1)+Cu====Zn+Cu2+(2.0mol·L-1)的方向。已知

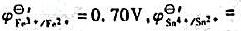 0.14V)
0.14V)
(1)根据电极点位表数据计算反应:
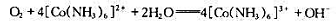
的平衡常数K.
(2)现将空气(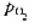 =20.3kPa)通入到含有0.10mol·dm-3[Co(NH3)6]3+,0.10mol·dm-3
=20.3kPa)通入到含有0.10mol·dm-3[Co(NH3)6]3+,0.10mol·dm-3
[Co(NH3)6]3+,2.0mol·dm-3NH2+及2.0mol·dm-3NH3·H2O的混合溶液中,能否发生上述反应?
A.Na2SO3已部分氧化
B.加入硝酸钡溶液生成的沉淀一定含BaSO4
C.加入HNO3后的不溶沉淀一定为BaSO4
D.此实验不能确定Na2SO3是否部分氧化
用0.1000mol/LHCl溶液滴定0.1000mol/LNa2CO3溶液至pH5.00。计算有百分之几的Na2CO3变成了H2CO3?剩下的主要组分是什么?如果煮沸溶液以除尽CO2,冷却后溶液的pH为多少?(H2CO3的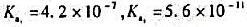 )
)
称取Na2HPO4·12H2O试剂0.8835g,以甲基橙为指示剂,用0.1012mol/LHCl滴定至