 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
将0.2mol/L HA(Ka=1.0×10-5)与0.2mol/L HB(Ka=1.0×10-9)等体积混合,混合后溶液的pH为( )。
A.3.0
B.3.15
C.3.3
D.4.15
E.4.3
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.3.0
B.3.15
C.3.3
D.4.15
E.4.3
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“将0.2mol/L HA(Ka=1.0×10-5)与0.2m…”相关的问题
更多“将0.2mol/L HA(Ka=1.0×10-5)与0.2m…”相关的问题
2mmol/L酸性缓冲液中含1mmol/L HA和1mmol/L[A-],pH=pKa=5(Ka=10-5)。若向1L缓冲液中加入0.5mmol/L量的H+(假定缓冲液体积仍是1L)。
A.1.0×10-6mol/L
B.1.0×10-7mol/L
C.1.0×10-8mol/L
D.1.0×10-9mol/L
在1.0 L某溶液中,含有HAc和HCN各0.10 tool,试计算该溶液中c(H+),c(Ac-)和c(CN-)各为多少?(已知:Kaθ(HAc)=1.76×10-5; Kaθ(HCN)=4.9×10-10)
有一弱酸HA,其离解常数Ka=6.4×10-7,计算c(HA)=0.30mol·L-1时溶液的c(H+)。
A.5×10-10B.
25℃时,下列电池的电动势为0.518V(忽略液接电位):
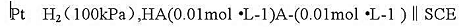
计算弱酸HA的Ka值.