 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算298K时,Fe3+/Fe2+,c(Fe3+)=0.1mol·L-1, c(Fe2+)=0.5mol·L-1 电对的电极。
计算298K时,Fe3+/Fe2+,c(Fe3+)=0.1mol·L-1, c(Fe2+)=0.5mol·L-1 电对的电极。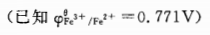
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算298K时,Fe3+/Fe2+,c(Fe3+)=0.1mol·L-1, c(Fe2+)=0.5mol·L-1 电对的电极。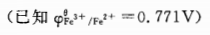
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算298K时,Fe3+/Fe2+,c(Fe3+)=0.1m…”相关的问题
更多“计算298K时,Fe3+/Fe2+,c(Fe3+)=0.1m…”相关的问题
计算298K时下列反应的摩尔吉布斯自由能变、标准平衡常数,并试用三种方法判断反应自发方向:
(1)Sn2+(0.050mol·L-1)+Pb=Pb2+(0.050mol·L-1)+Sn;
(2)Fe2+(1.0mol·L-1)+(1.0mol·L-1)+4H+(1.0×10-3mol·L-1)=3Fe3+(1.0mol·L-1)+NO(100kPa)+2H2O;
已知:(Sn2+/Sn)=-0.138V,(Pb2+/Pb)=-0.126V,(NO3-/NO)=0.957V,()Fe3+/Fe2+)=0.771V
298K时,Ag(s)|Ag+(a)的标准电极电势EΘ=0.799V,反应Fe3+(a2)+Ag(s)→Fe2+(a3)+Ag+(a1)的平衡常数KΘ=0.531,试求
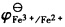 。
。
通过计算说明,反应 在标准状态时能否自发进行?已知
在标准状态时能否自发进行?已知

计算pH=3.0,含有未配位EDTA浓度为0.10mol•L-1时,Fe3+/Fe2+电对的条件电势。(已知pH=3.0时,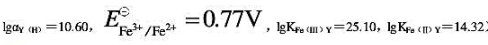 )。
)。
子强度的影响)。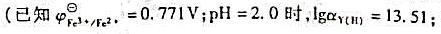
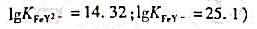
已知

测定铁矿中铁的含量时,称取试样0.3029g,使之溶解并将Fe3+还原成Fe2+后,用0.01643mol/L K2Cr2O7溶液滴定耗去35.14mL,计算试样中铁的质量分数。如果用Fe2O3表示,该K2Cr2O7对Fe2O3的滴定度是多少?
将反应2Fe2++3H++

