 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298.15K时,电极反应:V,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-2Ag+C2O2-4的标准电极电势。
已知298.15K时,电极反应: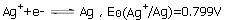 ,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-
,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e- 2Ag+C2O2-4的标准电极电势
2Ag+C2O2-4的标准电极电势 。
。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298.15K时,电极反应: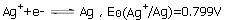 ,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-
,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e- 2Ag+C2O2-4的标准电极电势
2Ag+C2O2-4的标准电极电势 。
。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知298.15K时,电极反应:V,Ag2C2O4的Ksp为…”相关的问题
更多“已知298.15K时,电极反应:V,Ag2C2O4的Ksp为…”相关的问题
已知298.15K时, ,
, ,标准态时:(1)写出原电池符号(应自发进行);(2)写出电极反应及电池反应;(3)计算原电池的
,标准态时:(1)写出原电池符号(应自发进行);(2)写出电极反应及电池反应;(3)计算原电池的 ;(4)计算电池反应的
;(4)计算电池反应的 ;(5)求AgI的Ksp。
;(5)求AgI的Ksp。
在298K时,有电池:Ag(s)|AgCl(s)|NaCl(aq)|Hg2Cl2(s)|Hg(l)。已知化合物的标准生成Gibbs自由能分别为

已知298.15K时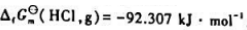 化学反应
化学反应
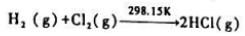
在催化剂的作用下反应速率大大加快时,反应的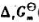 (298.15K)=().
(298.15K)=().
葡萄糖在空气中发生燃烧反应:

已知298.15K时空气中O2和CO2的分压分别为21.27kPa和0.0314kPa,
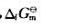 计算298.15K时该反应的摩尔吉布斯自由能变。
计算298.15K时该反应的摩尔吉布斯自由能变。
已知四氧化二氮的分解反应如下:

在298.15K时,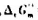 =4.75kJ·mol-1.试判断在此温度及下列条件下,反应进行的方向.
=4.75kJ·mol-1.试判断在此温度及下列条件下,反应进行的方向.
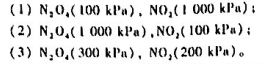
试求298.15K时,下述反应的KaΘ CH3COOH(1)+C2H5OH(1)==CH3COOC2H5(1)+H2O(1)已知各物质的标准生成自由能△fGmΘ。 物质 △fGmΘ(kJ/mol) CH3COOH(1) 一389.9 CH3COOC2H5(1) 一332.55 H2O(1) 一237.129 C2H5OH(1) 一168.49
已知下列反应在298.15K的平衡常数:
(1)SnO2(s)+2H2(g) 2H2O(g)+Sn(s)
2H2O(g)+Sn(s)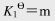
(2)H2O(g)+CO(g) H2(g)+CO2(g);
H2(g)+CO2(g);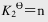
计算反应2CO(g)+SnO2(s) Sn(s)+2CO2(g)在298.15K时的平衡常数KΘ3。
Sn(s)+2CO2(g)在298.15K时的平衡常数KΘ3。
已知25℃时,电极OH-|Ag2O(s)|Ag及OH-,H2O|O2的标准电极电势分别为0.344V,△H=0.401V;-31.05kJ·mol-1,且其值不随温度而改变;空气的压力为101.325kPa,其中O2的摩尔分数为0.21。试求Ag2O(s)在空气中的分解温度为若干?
已知四氧化二氮的分解反应为N2O4(g)===2NO2(g)。在298.15K时,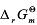 =4.75kJ·mol-1。试判断在此温度及下列条件下,反应进行的方向。
=4.75kJ·mol-1。试判断在此温度及下列条件下,反应进行的方向。
(1)N2O4(g,100kPa),NO2(g,100kPa);
(2)N2O4(g,1000kPa),NO2(g,100kPa);
(3)N2O4(g,300kPa),NO2(g,200kPa)。
A.在温度升高至一定数值以上即可自发进行
B.在温度降低至一定数值以上即可自发进行
C.在任何温度下反应都能自发进行
D.在任何温度下反应都不能自发进行