 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算c(HCl)=0.1015mol/L的HCl溶液对Na2CO3的滴定度。
计算c(HCl)=0.1015mol/L的HCl溶液对Na2CO3的滴定度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算c(HCl)=0.1015mol/L的HCl溶液对Na2CO3的滴定度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算c(HCl)=0.1015mol/L的HCl溶液对Na2…”相关的问题
更多“计算c(HCl)=0.1015mol/L的HCl溶液对Na2…”相关的问题
求0.1015mol/L HCl溶液对氨水的滴定度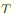 。已知M(NH3)=17.03g/mol。
。已知M(NH3)=17.03g/mol。
.00mLc(AgNO3)=0.1043mol/LAgNO3溶液,沉淀完全后加入5mL邻苯二甲酸二丁酯,用c(NH4SCN)=0.1015mol/L标准溶液回滴,用去21.45mL,计算烧碱中NaCl的含量。
计算1mol/L HCl溶液中c(Ce4+)=1.00×10-2mol/L,c(Ce3+)=1.00×10-3mol/L时电对的电位。
计算pH=8.0和4.00mol/L HCl溶液中As(Ⅴ)/As(Ⅲ)电对的条件电位。(忽略离子强度的影响。)
分析不纯的碳酸钙试样(其中不含干扰物质),称取试样0.3000g,加入c(HCl)=0.2500mol/L的HCl标准溶液25.00mL,煮沸除去CO2,用c(NaOH)=0.2012mol/L的NaOH溶液返滴定过量的HCl溶液,消耗NaOH溶液5.84mL,计算试样中CaCO3的质量分数。
现有含NaOH和Na2CO3的样品1.1790g,用水溶解后以酚酞为指示剂,加c(HCl)=0.3000mol/L HCl溶液48.16mL时,溶液变为无色,再加甲基橙指示剂,继续用该酸滴定,则需消耗24.08mL,计算样品中NaOH和Na2CO3的含量。
在1mol/L HCl溶液中,用Fe3+滴定Sn2-,计算下列滴定百分数时的电位:9%、50%、91%、99%、99.9%、100%、100.1%、101%、110%、200%。
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液的浓度都是0.0200mol/L,结果又如何?