 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取软锰矿(主要成分是MnO2)试样0.4000g,用0.5000g Na2C2O4处理,剩余的Na2C2O4用0.01000mol·L-1 KMnO4标准
称取软锰矿(主要成分是MnO2)试样0.4012g,用0.4488g Na2C2O4处理,剩余的Na2C2O4用0.01012mol·L-1KMnO4标准溶液30.20mL滴定至终点。计算试样中MnO2的质量分数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取软锰矿(主要成分是MnO2)试样0.4012g,用0.4488g Na2C2O4处理,剩余的Na2C2O4用0.01012mol·L-1KMnO4标准溶液30.20mL滴定至终点。计算试样中MnO2的质量分数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取软锰矿(主要成分是MnO2)试样0.4000g,用0.5…”相关的问题
更多“称取软锰矿(主要成分是MnO2)试样0.4000g,用0.5…”相关的问题
测定软锰矿中MnO2的含量,准确称取软锰矿试样0.5261g,在酸性介质中加入0.7049gNa2C2O4。待反应完全后,过量的乙二酸用0.02160mol·L-1KMnO4标准溶液滴定,用去30.47mL,计算MnO2的质量分数。
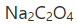 ,然后求出MnO2的含量。不用还原剂的标准溶液直接滴定的原因是( )。
,然后求出MnO2的含量。不用还原剂的标准溶液直接滴定的原因是( )。A.没有合适的还原剂
B.没有合适的指示剂
C.由于MnO2是难溶物质,直接滴定不适宜
D.防止其他成分干扰
E.滴定剂易分解
称取软锰矿0.3216g和分析纯的Na2C2O40.3685g,共置于同一烧杯中,加入H2SO4,并加热;待反应完全后,用0.02400mol/L KMnO4溶液滴定剩余的Na2C2O4,消耗KMnO4溶液11.26mL。计算软锰矿中MnO2的质量分数。
称取锰矿试样1.000g,用Na2O2熔融后,得Na2MnO4溶液。煮沸除去过氧化物后酸化,此时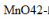 歧化为
歧化为 和MnO2,滤去MnO2,滤液与0.1000mol/L的Fe2+标液反应,消耗了25.00mL。计算试样中MnO的质量分数。
和MnO2,滤去MnO2,滤液与0.1000mol/L的Fe2+标液反应,消耗了25.00mL。计算试样中MnO的质量分数。
称取含甲酸(HCOOH)试样0.2040g,溶解于碱性溶液后加入0.2010mol/LKMnO4溶液25.OOmL,待反应完成后,酸化,加入过量的KI还原过剩的

锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量FeO、A1A、Si02等杂质)为原料制备锰酸锂的流程如下图所示。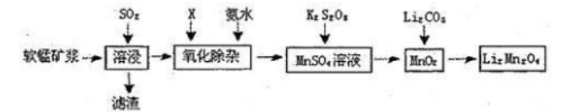 (1)溶浸生产中为提高SO2吸收率可采取的措施有()(填序号)。
(1)溶浸生产中为提高SO2吸收率可采取的措施有()(填序号)。
A、不断搅拌,使SO2和软锰矿浆充分接触
B、增大通入SO2的流速
C、减少软锰矿浆的进入量
D、减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,,Ksp[Fe(OH)3]=l×10-39,pH=7.1时Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+,Al3+(使其浓度小于1×l06mol.L-1),需调节溶液范围为()。
(3)由硫酸锰与K2S2(V溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式()。
(4)将MnO2和Li2O3按4:1的物质的量比配料,混合搅拌,然后升温至600℃〜750℃,制取产品LiMn2O4。写出该反应的化学方程式()。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC LiMn2O4+C(0
LiMn2O4+C(0
<x<1)
①充电时,电池的阳极反应式为(),若此时转移lmole-,则石墨电极将增重g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是()。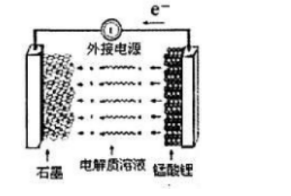
甲酸钠和在中性介质中按下述反应式反应
3HCOO-+2MnO42-+H2O=2MnO2+3CO2+5OH-
称取HCOONa试样0.5000g,溶于水后,在中性介质中加入过量的0.06000mol·L-1KMnO4溶液50mL,过滤除去MnO2沉淀,以H2SO4酸化溶液后,用0.1000mol·L-1H2C2O4溶液滴定过量的KMnO4至终点,消耗25.00mL.计算试样中HCOONa的质量分数.
称取含铝试样0.2000g溶解后,加入0.02082mol/L EDTA标准溶液30.00mL,控制条件使Al3+与EDTA配合完全,然后以0.02012mol/L Zn2+标准溶液返滴定,消耗Zn2+标准溶液7.20mL。计算试样中Al2O3的质量分数。(已知:MAl2O3=102.0)
测煤中含硫量时,称取试样2.100g,经燃烧处理成H2SO4后,往其中加入0.1000mol·L-1BaCl225.00mL。过量BaCl2用0.08800mol·L-1Na2SO4标准液滴定至终点,消耗1.00mL,计算试样中S的质量分数。
称取可溶性氯化物样品0.2266g,加入30.00mLc(AgNO3)=0.1121mol/L的AgNO3标准溶液,过量的AgNO3用c(NH4SCN)=0.1185mol/L的NH4SCN标准溶液滴定,用去6.50mL,计算试样中氯的质量分数。