 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用价层电子对互斥理论预测H2S和BF3的空间构型,两个结论都正确的是()
A.直线形,三角锥型
B.V形,三角锥型
C.直线形,平面三角形
D.V形,平面三角形
 答案
答案
D、V形,平面三角形
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.直线形,三角锥型
B.V形,三角锥型
C.直线形,平面三角形
D.V形,平面三角形
 答案
答案
D、V形,平面三角形
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用价层电子对互斥理论预测H2S和BF3的空间构型,两个结论都…”相关的问题
更多“用价层电子对互斥理论预测H2S和BF3的空间构型,两个结论都…”相关的问题
试根据价层电子对互斥理论推出下列情况下ABn型分子的几何构型:
(1)中心原子A的价层电子对数为6,配体B的个数n=4;
(2)中心原子A的价层电子对数为5,配体B的个数n=2。
并利用得出的结论判断下列分子或离子的几何构型:
(3)I3-;(4)XeF2;(5)XeF4;(6)ICl4-。
简要回答下列问题:
(1)电解NaCl熔盐制取金属Na的过程中,为什么要加入CaCl2?由此带来的负面影响是什么?
(2)为什么金属Mg与冷水反应极慢,却可以迅速与热水或NH4Cl水溶液发生反应?
(3)什么是离子势φ?为什么φ的大小可以影响一些氧化物的水化物的解离方式?
(4)为什么加热MgCl2·6H2O时得不到无水盐?
(5)为降低煤炭燃烧时排向大气的SO2量,可以把CaO或CaCO3掺到含硫的煤炭中。试说明这种做法的化学原理,写出相关的化学反应方程式。
(6)Li+和Mg2+半径十分接近,试分析它们的碳酸盐分解温度的高低。
(7)锂的第一电离能比钠大,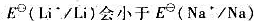 ?既然
?既然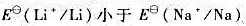 ,为什么锂与水的反应却不如钠剧烈?
,为什么锂与水的反应却不如钠剧烈?
(8)试说明锂的哪些性质与镁相似而有别于钠、钾。
(9)试说明铍的哪些性质与铝相似而有别于镁、钙。
(10)试用价层电子对互斥理论和杂化轨道理论,讨论XeF6分子的几何构型和中心原子的轨道杂化方式。
给出合理解释: (1)Ga的第一电离能(578.8kJ.mol-1)比Al的第一电离能(577.5kJ.mol-)要高。 (2)AlF3的熔点比AlCl3高得多。 (3)熔融的AlBr3不导电,而它的水溶液却是良导体。 (4)Tl(OH)与KOH的碱性一样。 (5)A1(Ⅲ)可以形成
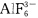 ,而B(Ⅲ)不能形成
,而B(Ⅲ)不能形成
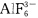 。 (6)能制得TlF3,但不能制得TlI3,却制得了TII。 (7)在蒸气下AlCl3为双聚体,而BCl3却不能发生二聚。 (8)TlI与KI同晶形,但TlI不溶于水。 (9)用路易斯酸碱理论和结构知识分析BF3和NH3作为酸碱的可能性。 (10)AlF3不溶于水,但可溶于HF中。 (11)BF3和BCl3中,哪一个是更好的电子接受体? (12)H3BO3在冷水中的溶解度很小,加热时,溶解度增大。 (13)BH3不存在,而BF3却能稳定存在。
。 (6)能制得TlF3,但不能制得TlI3,却制得了TII。 (7)在蒸气下AlCl3为双聚体,而BCl3却不能发生二聚。 (8)TlI与KI同晶形,但TlI不溶于水。 (9)用路易斯酸碱理论和结构知识分析BF3和NH3作为酸碱的可能性。 (10)AlF3不溶于水,但可溶于HF中。 (11)BF3和BCl3中,哪一个是更好的电子接受体? (12)H3BO3在冷水中的溶解度很小,加热时,溶解度增大。 (13)BH3不存在,而BF3却能稳定存在。
A.均为平面三角形
B.BF3为平面三角形,NH3为三角锥形
C.均为三角锥形
D.BF3为三角锥形,NH3为平面三角形