更多“下列滴定能否进行?如能进行,计算化学计量点的pH,并指出选用…”相关的问题
更多“下列滴定能否进行?如能进行,计算化学计量点的pH,并指出选用…”相关的问题
第1题
在0.1mol·L-1HCl溶液中,用Fe3+滴定Sn2+,其反应为:2Fe3++Sn2+=2Fe2++Sn4+(1)计算下列反应的化
在0.1mol·L-1HCl溶液中,用Fe3+滴定Sn2+,其反应为:
2Fe3++Sn2+=2Fe2++Sn4+
(1)计算下列反应的化学计量点的电位和滴定到99.9%和100.1%时的电位。
(2)计算平衡常数及讨论反应进行的完全程度。
第4题
在含有0.2 mol.dm-3游离NH3的pH=10.0的氨性缓冲溶液中,以0.020 mol.dm-3EDTA滴定同浓度的Cu2+,计
算化学计量点时的pCu’。在上述相同条件下,如滴定的是0.020 mol.dm-3 Mg2+,化学计量点时的pMg是多少?若Cu2+与Mg2+同时存在,怎样才能进行连续滴定?简述其理由。(lgKfθ(CuY)=18.8;lgKfθ(MgY)=8.7;pH=10.0时,lgα(Y(H))=0.45,α(Cu(OH))=101.7,Cu2+一NH3络合物的lgβ1~lgβ4分别为4.31,7.98,11.02,13.82)
点击查看答案
第5题
用法杨司法测定溶液中的C1-含量,下列说法不正确的是()。
A.标准滴定溶液是AgNO3溶液
B.滴定化学计量点前AgC1胶体沉淀表面不带电荷,不吸附指示剂
C.化学计量点后微过量的Ag+使AgC1胶体沉淀表面带正电荷,指示剂被吸附,呈现粉红色指示终点
D.计算:n(C1_)=n(Ag+)
第8题
下列是用0.1000mol·L-1NaOH溶液电位滴定某弱酸试液[10mL弱酸+10mL(1mol·L-1)NaNO3+80mL
下列是用0.1000mol·L-1NaOH溶液电位滴定某弱酸试液[10mL弱酸+10mL(1mol·L-1)NaNO3+80mL
点击查看答案
水]的数据:
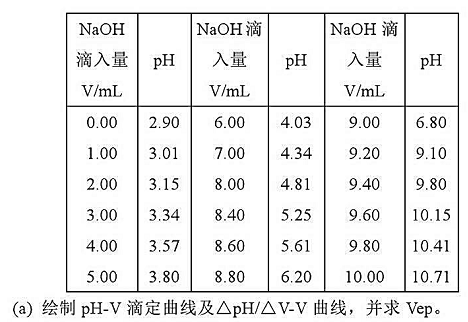
(b)用二阶微商法计算Vep,并与(a)的结果比较.
(c)计算弱酸的浓度.
(d)化学计量点的pH值应是多少?
第9题
计算在1 mol.L-1HCI溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电
势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电位滴定判断终点,与计算所得化学计量点电势一致吗?(Eθ’(Fe3+/Fe2+)=0.68V;Eθ’(Sn4+/Sn2+)=0.14 V)
点击查看答案
第10题
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液的浓度都是0.0200mol/L,结果又如何?



 如果结果不匹配,请
如果结果不匹配,请